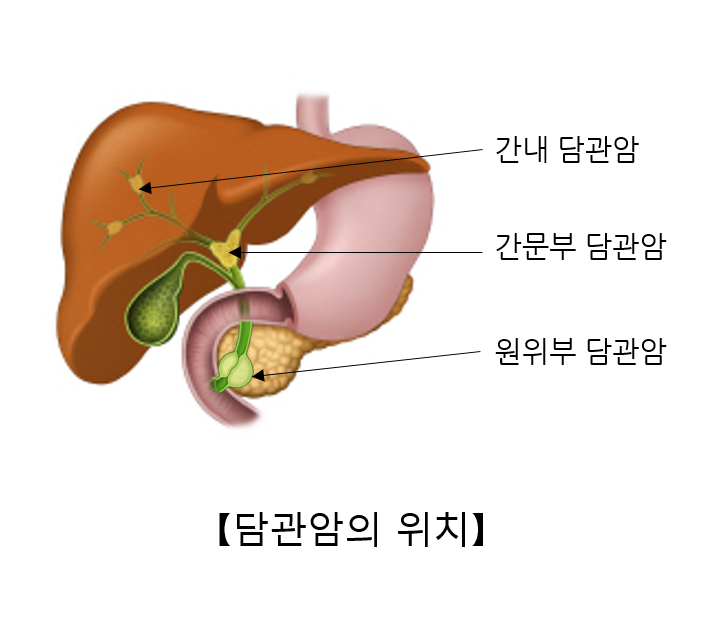
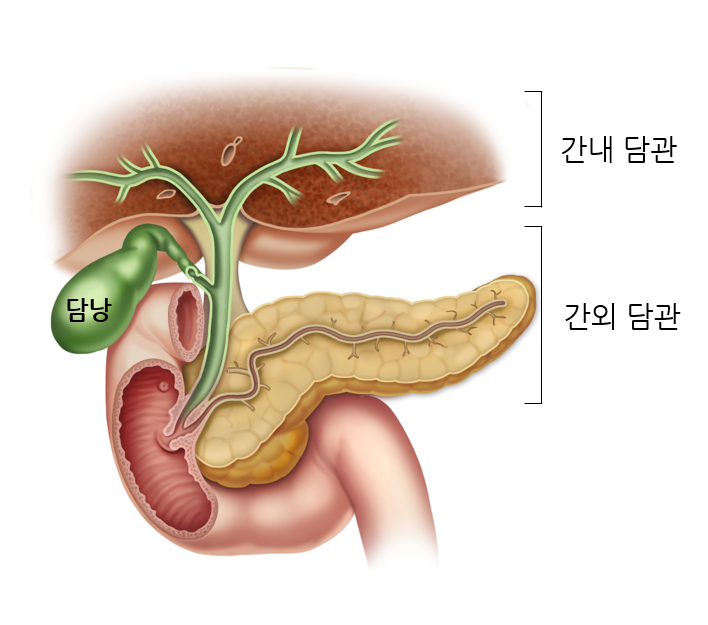
담관암, 담관암 담관암종 담낭암은 담낭에서 발생하는 암세포로 구성된 덩어리입니다. 담낭 세포에서 발생하는 선암종이 암의 대부분을 차지하므로 담낭암은 일반적으로 담낭 선암종을 말합니다. 그 밖에도 미분화암, 편평세포암종, 극세포종이 있으며, 드물게 유암종, 림프종, 간질종양, 과립세포종, 악성흑색종이 발생할 수 있습니다. 담관암종은 담관의 상피와 그 위치를 닮은 세포로 구성된 종양입니다. 이에 따라 간내 담관암과 간외 담관암으로 구분됩니다. 간내 담관암종은 다시 말초 담관암종과 간문부 담관암종으로 분류됩니다. 간외 담관암은 발생 부위에 따라 상부(근위) 담관암, 중부(중간) 담관암, 하부(원위) 담관암으로 분류됩니다. 담낭암의 발생 기전은 아직 명확히 밝혀지지 않았습니다. 담낭암 발병의 위험인자로는 담석, 만성담낭염, 비정상 췌담관 합류부, 석회화된 담낭, 장티푸스 보균자, 각종 화학물질 등이 있으나, 이들이 어떠한 과정을 거쳐 담낭암 발병과 연관되는지는 아직까지 불분명합니다. .지금까지 알려진 담관암의 위험인자로는 담관정체, 만성염증, 만성감염, 발암물질에의 노출 등이 있으나, 특히 노인의 담관암의 경우 특별한 선행 위험인자를 찾아볼 수 없는 경우가 많습니다. 찾기가 어렵습니다. 또한, 간흡충 등의 만성 간담도 기생충 감염, 담관 확장을 동반한 선천성 기형, 원발성 경화성 담관염, 만성 궤양성 대장염, 직업상 담도암 유발 요인에 대한 노출(고무 공장이나 자동차 공장에서 일하는 사람들), 가족성 용종증 등이 있습니다. , 선천성 간 섬유화 등이 위험 요인으로 간주됩니다. = 서울대병원 정보 참고 = 간흡충 관련 담도암 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5945254/ 연구원은 태국인이고, 간흡충 감염은 담관암종에 의해 발생합니다( CCA의 주요 위험 요소로 간주됩니다. 아래 국내 기생충 감염 통계에서도 일부에서는 간흡충이 원인이라고 생각하는 데이터가 나와 있다. 간흡충 감염에 대한 현재 치료법은 PraziQuantel입니다. 프라지콴텔의 표준용량은 75mg/kg, 하루 3회이다. 다중 분할 용량은 O. viverrini 및 C. sinensis 감염 모두에 대해 98% ~ 99%의 치료율을 갖습니다. 트리벤디미딘이라는 신약이 간 흡충 치료를 위한 유망한 약물로 제안되었습니다. 트리벤디미딘은 간 흡충뿐만 아니라 십이지장충, 회충증 및 장내 기생충과 같은 일부 장 회충에 대한 활성을 가지고 있습니다.O. viverrini와 C. sinensis 모두에 대해 400mg 단일 용량의 트리벤디미딘을 사용한 치료는 프라지콴텔과 98-99% 유사했으며 부작용이 더 적었습니다. 트리벤디미딘의 가장 흔한 부작용은 현기증, 현기증, 두통, 메스꺼움 및 피로였습니다. 담관암종의 간 흡충 관련 발암 경로에는 담관 상피의 기계적 손상, 간 흡충 항원 및 배설물에 대한 면역병리학적 및 세포 반응, 간 흡충에 의한 담관 미생물 군집의 변화로 여겨집니다. 국내 기생충 감염 자료를 보면 간흡충 같은 기생충은 간경화, 담관염, 담관암종 등을 일으킬 수 있다. 다른 통계에서도 전체 암의 20%가 기생충(미세미생물)에 의해 발생한다고 언급하고 있다. https://blog.naver.com /grsanga/222674359181
국내 기생충 감염관리 성공사례 검토 서울대학교 의과대학 열대의학 및 기생충학과, 홍성태, 연세대학교 의과대학 환경의과학교실, 용태선, 연세대 기생충학과 환경의학과 대학교 의과대학 용태선 서울대학교 의과대학 기생충내과학교실… blog.naver.com
인간 담관암종에서 대사 가소성의 다각적 측면: 현재 관점 개요 https://www.mdpi.com/2073-4409/9/3/596/htm#B33-cells-09-00596 이 논문에서는 또한 담관암종에 다양한 요인이 있다고 명시합니다. 대사 매개체는 많은 신호 전달 경로를 조절하여 담관암 진행에 중요한 역할을 한다고 합니다. 즉, 제목에서 알 수 있듯이 담관암종 자체는 열악한 영양 환경에서도 생존할 수 있으며 생존, 증식, 전이를 유지하여 세포 성장을 극대화할 수 있습니다. (대사 가소성) 담관암종은 여러 대사 관련 경로를 변경하고 불균형한 대사 미세 환경을 만들 수 있기 때문에 어려운 것으로 보입니다. 최근 면역 표현형에 대한 대사 영향이 주요 관심사로 대두되었습니다. (M1, M2 대식세포) 담관암종의 변형된 대사경로는 글의 마지막 부분에 첨부하겠습니다. 담도암 및 담관암종 치료에 효과적인 대체항암제로는 시메티딘, 메트포르민, 스타틴, 메벤다졸, 이버멕틴, DCA, 오메프라졸, TUDCA, 살리노마이신, 레바미솔, 클로로퀸, 니클로사마이드, 니타족사니드, 피르비늄, 알벤다졸, 티모퀴논, 멜라토닌 등이 있다. 시메티딘 시메티딘은 Akt 인산화를 억제하여 CCA(담관암종) 세포를 억제합니다. 유도된 카스파제 의존성 세포사멸. 관찰 가능한 부작용 없이 인간 CCA 보유 마우스의 종양 성장을 억제했습니다.

인간 CCA 보유 마우스에게 12일 동안 매일 복강내 주사를 통해 200 mg/kg의 시메티딘을 투여했습니다. 결론적으로, 이 연구는 시험관 내 및 생체 내에서 시메티딘의 강력한 항CCA 활성을 입증했습니다. 시메티딘은 위암과 대장암에 효과적입니다. 이는 악성 종양 환자의 생존율을 향상시키고, 생쥐에서 골수 유래 억제 세포 사멸을 유도하며, 암세포 증식 억제, 종양 혈관 신생 차단, 면역 활동 강화 등 다양한 메커니즘을 통해 종양 성장을 억제하는 것으로 입증되었습니다. . 시메티딘과의 병용 치료는 CCA 환자 치료에 사용되는 현재 화학 요법(5-플루오로우라실 또는 젬시타빈 및 옥살리플라틴)의 효과를 강화할 수 있습니다. https://blog.daum.net/health-life/ 141

종양학에서의 약물 용도 변경(ReDO) – 항암제로서의 시메티딘 종양학에서의 약물 용도 변경(ReDO) – 항암제로서의 시메티딘 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4268104/ 종양학에서의 약물 용도 변경( ReDO)—항암제로서의 시메티딘 Cimetidine,..blog.daum.net

메트포르민메트포르민은 생체 내에서 세포 성장을 유의하게 억제하여 종양의 부피와 무게를 감소시킵니다. 또한 Metformin으로 치료받은 CCA 환자는 종양 크기가 감소하고 수술 후 생존율이 향상되었습니다. 그러나 IDH-1 돌연변이 간내 담관암종에 대해서는 유의한 임상 활성을 나타내지 않습니다. 메트포르민은 화학요법을 받은 환자에서도 상당한 개선을 보였습니다. 메트포르민은 CCA 예방 및 치료를 위한 매우 유망한 전략일 수 있습니다. 세포주기 정지에 의한 CCA 종양 성장 억제. 간내 CCA 세포의 AMPK/mTORC1 경로는 메트포르민의 표적입니다. Metformin은 여러 발암성 miRNA의 Drosha 매개 발현 조절을 통해 CCA 종양 성장을 억제했습니다. 메트포르민의 사용은 간경변증 환자에게 안전한 것으로 보이며 생존 혜택을 제공합니다. 아래 논문을 포함한 많은 논문에서 담관암종에 대한 메트포르민의 효과를 언급하고 있습니다. https://ascopubs.org/doi/abs/10.1200/JCO.2022.40.16_suppl.e16132 https://pubmed.ncbi.nlm.nih. gov/26745042/https://www.nature.com/articles/s41598-021-81172-0스타틴 친유성 및 소수성 스타틴은 담도암(BTC), 특히 담관암종(CCA) 및 담낭암의 위험을 낮추는 것과 관련이 있습니다( GBC). 관련 내용은 다음과 같습니다: https://pubmed.ncbi.nlm.nih.gov/35698295/스타틴은 세포 분열을 억제하고 세포사멸을 유도하여 인간 담관암종 세포에 세포 독성을 나타냅니다. 스타틴은 간외 담관암종(ECC)의 위험과 4배 연관되어 있습니다 원위 담관암종(dCCA) 환자의 생존율을 향상시킬 수 있습니다. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8155698/#R24 시험관 내 연구에서 아토르바스타틴은 세포질에서 자가포식소체의 산화를 억제했습니다. 이는 AMP 활성화 단백질 키나제(AMPK)의 형성, 활성화 및 소포체 스트레스 반응 활성화와 같은 다양한 메커니즘을 통해 세포 사멸 및 자가포식을 유도했습니다. (24) 로바스타틴은 인테그린 β3의 발현을 감소시키고 종양 억제 인자 LKB1을 활성화함으로써 담관암종 세포주에서 세포 증식과 이동을 억제했습니다. (25) 로바스타틴과 게피티닙의 병용 치료는 인간 담관암종 세포에서 TNF-α mRNA의 발현을 증가시키고 LKB1 활성화를 통해 세포 주기 정지를 조절했으며, 게피티닙은 TNF-α 발현을 강화시켜 항로바스타틴제였습니다. 확산 특성이 강화되었습니다. (26) 유사하게, 심바스타틴은 쥐 결장암 세포에서 ROS 방출을 통해 산화 스트레스를 유도하고 세포사멸을 유도했습니다. (27) 심바스타틴은 또한 E2F 전사 인자 1(E2F-1)과 티미딜레이트 신타제(TS)의 발현을 하향 조절하여 담관암종 세포를 5-FU에 감작시킴으로써 담관암종 세포를 5-FU에 감작시킵니다. 향상된 독성 및 세포사멸 활성. (28) 심바스타틴의 다발성 발현 효과는 인간 담관암종 세포주의 콜레스테롤 수치 감소를 통해 Rac1 활성을 하향 조절하고 지질 뗏목에서 Rac1 위치를 방해함으로써 더욱 확립됩니다. (29) 피타바스타틴은 인간 ICC 및 ECC 세포주에서 세포 직경 감소 및 가성족 형성 감소와 같은 형태학적 변화를 유도했습니다. 인간 간외 담관암종 세포주에 대한 젬시타빈, 5-FU 및 시스플라틴의 항증식 활성은 이전에 보고되었습니다. 이는 피타바스타틴에 대한 노출로 인해 강화되었습니다. (30) 이러한 효과 중 일부는 용량 의존적이지만 중등도 스타틴 사용은 저강도 또는 고강도 스타틴 사용에 비해 ECC 및 그 하위 유형의 위험 감소와 유의미한 관련이 있습니다. 메벤다졸 담관암종 시험관 내 및 생체 내에서 메벤다졸이 (CCA) 세포에 미치는 영향을 조사한 결과, 메벤다졸이 카스파제-3 활성화된 세포 사멸을 통해 CCA 세포 증식을 억제할 수 있음이 시사되었습니다. https://pubmed.ncbi.nlm.nih .gov/26466412/IvermectinIvermectin은 항CCA 활성을 발휘하며 gemcitabine 내성 KKU214GemR 세포는 ivermectin 치료에 더 민감합니다. 따라서 이버멕틴은 특히 젬시타빈에 반응하지 않는 환자의 경우 CCA의 대체 치료법으로 유용할 수 있습니다. 이는 이버멕틴이 기존 화학요법 약물에 내성이 있는 종양을 치료하는 데 가능성이 있음을 시사합니다. https://pubmed.ncbi.nlm.nih.gov/31519586/salinomycin 살리노마이신은 자가포식을 촉진합니다. 담관암종의 성장을 억제합니다. Levamisole 진행성 간내 담관암종 환자 치료에 대한 levamisole의 임상 시험(NCT03940378). 니클로사마이드, 니타족사니드, 피르비늄, 알벤다졸 등 다른 항암 구충제가 효과적입니다. 작동하는 것 같습니다. 담관암에 대한 직접적인 연구 결과는 미흡하지만 유추할 수는 있다. 아스피린 담관암 예방 및 치료에서 아스피린의 잠재적인 역할 https://pubmed.ncbi.nlm.nih.gov/32997790/Accurate 작용 기전은 불분명하지만 아스피린의 다양한 하류 효과는 담관암 발생, 종양 발생을 방해할 수 있습니다. COX-2 경로 억제, 혈소판 응집 방지, 특정 단백질 및 신호 조절을 포함한 성장 및 전이. 아스피린을 정기적으로 사용하면 담관암 발생, 종양 성장 및 전이를 방해할 수 있습니다. 이는 대장암 및 담관암종의 발생률 감소 및 생존율 향상과 관련이 있습니다. 담관암종 위험에 대한 아스피린 및 비스테로이드성 항염증제의 효과: 메타 분석 https://pubmed.ncbi.nlm.nih.gov/30753687/아스피린 사용 및 CCA는 위험을 0.56배 감소시키는 유의미한 연관성을 보여줍니다. 그러나 NSAID 사용과 CCA 사이에는 연관성이 없습니다.티모퀴논티모퀴논: 다양한 의료 응용이 가능한 새로운 천연 약물https://www.ncbi.nlm.nih.gov/pmc/ 기사/PMC9737800/ 티모퀴논은 Nigella sativa라는 식물에서 발견되는 화합물입니다. 블랙씨드 오일의 주요 활성 화합물입니다. 티모퀴논은 간세포암종과 담관암종 세포주에 항증식 효과가 있었고 용량 및 시간에 따른 성장 억제를 초래하고 여러 단계에서 세포 주기 정지를 유도했으며 두 세포주 모두에서 세포사멸을 유도했습니다. 티모퀴논은 간세포암종 및 담관암종 치료를 위한 항종양제로서 유망한 치료 잠재력을 가지고 있습니다. 멜라토닌간암의 항종양제로서의 멜라토닌: 업데이트된 체계적 검토 https://www.ncbi.nlm. nih.gov/pmc/articles/PMC7828223/멜라토닌은 발암을 예방하고 단독으로 또는 다른 화합물과 함께 원발성 간 종양, 간세포암종(HCC) 및 담관암종(CCA)에 대한 유망한 치료 옵션으로 유용한 작용을 나타냅니다. 요약하면, 산화 스트레스, 증식, 혈관 신생 및 침입 억제, 면역 체계 반응 촉진, 세포 주기 정지 및 세포사멸, 일주기 리듬 및 자가포식 조절 회복 등 간 종양 치료 환경을 개선하는 데 있어 멜라토닌의 이점이 있습니다. 암 줄기 유사 담관암종에 대한 유망한 치료 전략으로 젬시타빈과 메트로니다졸 병용의 잠재적인 역할이 있습니다 https://blog.naver.com/grsanga/222799900462

암 줄기 유사 담관암종 치료에 젬시타빈과 메트로니다졸 병용젬시타빈과 메트로니다졸 병용은 암 줄기 유사 담관암종에 대한 유망한 치료 전략 https://ar.iiarjournals.o… blog.naver.com 메트포르민과 메트로니다졸의 Ib상 임상시험 IDH1 돌연변이 고형종양 환자의 클로로퀸 https://pubmed.ncbi.nlm.nih.gov/34069550/ IDH1(isocitrate dehydrogenase 1)의 돌연변이는 연골육종의 60%를 차지하며, WHO 2~4등급의 80%에서 발생 신경교종 및 간내 담관암종의 20%. 이러한 IDH1 돌연변이 종양은 종양 대사물질인 D-2-하이드록시글루타레이트(D-2HG)를 생성하며 대사 장애에 더 취약합니다. IDH1 돌연변이 연골육종, 신경교종, 간내 담관암종 환자의 당뇨병. 치료제인 메트포르민과 항말라리아제인 클로로퀸을 경구 병용 투여했으며, 일차 목표는 용량 제한 독성(DLT)의 발생과 최대 허용 용량(MTD)을 결정하는 것이었습니다. MTD는 메트포르민 1500mg을 1일 2회, 클로로퀸 200mg을 1일 1회 투여하는 것으로 결정되었습니다. 진행성 IDH1 돌연변이 고형 종양에 대한 메트포르민 및 클로로퀸 치료는 내약성이 좋았지만 이 Ib상 임상 시험에서는 임상 반응을 유도하지 못했습니다. ( NCT02496741 ) 네오알바코놀은 PTEN을 상향 조절하여 인간 담관암종 세포의 성장을 억제합니다 https: //pubmed.ncbi.nlm.nih.gov/27158342/Neoalbaconol은 최근 Albatrellus confluens에서 분리된 작은 분자로 억제 능력이 있는 것으로 제안되었습니다 많은 암세포의 세포 성장. 네오알바코놀은 염색체 10(PTEN)에서 검출된 인산 및 균주 상동체를 표적으로 삼아 AKT 경로를 통해 암세포 사멸을 유도할 수 있음이 입증되었으며, 이는 네오알바코놀이 인간 담관암종에 대한 새로운 화학요법 치료법이 될 수 있음을 시사합니다. 존재한다는 사실을 뒷받침합니다. Albatrellus confluens: 방패버섯 https://health-tumor.tistory.com/359 방패버섯: 네오알바코놀, 혈관 신생과 종양 성장을 억제합니다. 네오알바코놀은 EGFR 매개 VEGF 생산을 억제하여 혈관 신생과 종양 성장을 억제합니다. 하다. Molecular Carcinogenic ( IF 4.784 ), 발행일: 2016-12-21 , DOI: 10.1002/mc.22602 Albatrellus confluens에서 추출한 네오알바코놀은 이전 연구에서 항암 활성을 보여주었습니다. 데이터에 따르면 네오알바코놀은 유방암 세포의 증식을 억제하고 세포사멸을 유도할 수 있습니다. 또한, 네오알바코놀은 시험관 내에서 혈관내피성장인자(VEGF)에 의해 유도된 인간 탯줄을 유도하는 것으로 나타났습니다… health-tumor.tistory.com 54세 여성의 담관암 4기가 호전된 해외 사례가 있습니다 . 다른 경우도 있으니 블로그에서 (담도암), (담도암)을 검색하시면 됩니다. 주로 사용되는 약물로는 펜벤다졸, 강황, CBD, 아스피린, 로라티딘, 밀크씨슬, 시메티딘, 베르베린 등이 있습니다. https://blog.naver.com/grsanga/222589255425 (해외 개선사례) 54세 여성 담관암 4기 (해외 개선사례) 54세 여성 담도암 4기 병기 진단 2018년 2월 7일 4차 담관암. Jess** 54세, 2명의 어린 자녀를 둔 여성 (딸…blog.naver.com) 이전 해외 연구에서는 오메프라졸과 타목시펜이 디클로로아세테이트의 항종양 효과를 다음과 같이 향상시켰습니다. 활성산소를 발생시켜 담관암의 진행을 3개월간 예방하였습니다. 차단한 것으로 알려졌습니다. https://blog.naver.com/grsanga/222759059742 (해외 논문 개선 사례) 디클로로아세테이트(DCA)와 이버멕틴의 시너지 항종양 효과 이전에 디클로로아세테이트, 오메프라졸, 타목시펜의 조합에 대해 보고한 바 있습니다. 이는 젖산 생성과 과산화물 감소…blog.naver.com 담관암 표적 약물 치료 https://www.cancer.org/cancer/bile-duct-cancer/treating/targeted-therapy.htmlFGFR2 억제제FGFR(섬유아세포 성장 인자 수용체) 세포가 정상적으로 성장하고 분열하도록 돕는 단백질입니다. 간 담관암종 환자 중 소수(약 15%)는 FGFR을 생성하는 유전자에 변화가 있어 비정상적인 FGFR 단백질이 생성되고 세포가 통제할 수 없게 회전하게 됩니다. 자라서 암으로 변할 수 있습니다. 페미가티닙(Pemazyre)과 인피그라티닙(Truseltiq)은 FGFR2 억제제입니다. 이는 담관암종 세포에서 비정상적인 FGFR2 단백질을 차단하여 이들이 성장하고 다른 곳으로 퍼지는 것을 방지합니다. 이 약물은 수술적으로 사용됩니다. 제거할 수 없거나 1회 이상의 이전 화학요법 치료 후 먼 지역으로 퍼진 일부 진행성 담관암을 치료하는 데 사용할 수 있습니다. 이러한 약물 중 하나를 시작하기 전에 암에 이상이 있어야 하기 때문입니다. 이러한 약물이 작동하도록 하는 FGFR2 유전자. 검사를 받아야 합니다. 페미그라티닙을 2주 동안 1일 1회 경구 정제로 투여한 후 1주 동안 중단한 후 다시 투여합니다. 인피그라티닙을 3주 동안 1일 1회 정제로 투여한 후 1주 동안 중단한 후 다시 시작합니다.가능 FGFR2 억제제의 부작용FGFR2 억제제의 가장 흔한 부작용으로는 신장 문제, 탈모, 설사, 변비, 손톱 문제, 피로, 미각 변화, 메스꺼움, 구토, 구강 건조 또는 구강 궤양이 있습니다. 여기에는 식욕 부진, 피부 건조, 눈 건조, 수족 증후군, 복통, 혈중 미네랄 수치 변화 등이 포함됩니다. IDH1 억제제 담관암종을 앓고 있는 일부 환자의 경우 암세포는 IDH1 유전자의 변화(돌연변이)를 일으키며, 이는 일반적으로 다음과 같은 증상을 유발합니다. IDH1 단백질을 사용하는 세포. 그것은 당신이 그것을 만드는 데 도움이됩니다. 이 유전자의 돌연변이는 비정상적인 IDH1 단백질을 생성하여 세포가 정상적으로 성숙하는 것을 방해할 수 있습니다. Ivosidenib(Tibsovo)는 IDH1 억제제입니다. 비정상적인 IDH1 단백질을 차단하면 암세포가 보다 정상적인 세포로 성숙하는 데 도움이 되는 것으로 보입니다. 이 약은 이전에 치료받은 진행성 담관암종 환자의 암세포에 IDH1 돌연변이가 있는 것으로 밝혀진 경우 사용할 수 있습니다. 의사는 암세포를 검사하여 IDH1 돌연변이가 있는지 확인할 수 있습니다. 이 약은 1일 1회 경구 복용합니다. 이보시데닙의 가능한 부작용 일반적인 부작용으로는 피로, 메스꺼움, 구토, 복부(복부) 통증 또는 부종, 설사, 식욕 부진, 기침, 낮은 적혈구 수(빈혈), 발진, 약물이 영향을 미치는 것을 보여주는 실험실 테스트 등이 있습니다. 간. 변경사항이 포함될 수 있습니다. 덜 일반적이지만 더 심각한 부작용으로는 심박수 변화, 폐렴, 황달(눈과 피부가 노랗게 변함) 등이 있습니다. 표 1. 담관암종의 주요 변화된 대사 경로https://www.mdpi.com/ 2073- 4409/9/3/596/htm#B33-cells-09-00596 대사 경로대사 표적담관암종(CCA)에 대한 영향참고자료포도당 대사GLUT-1 상향 조절체외에서 CCA 세포 침윤과의 상관관계.CCA는 더 큰 종양 크기, 불량한 분화, 전이 및 불량한 상관관계 예후.(33, 34, 35) CCA 세포에서 PPP 상향 자극 및 항산화 능력과 시스플라틴 저항성의 지속.(36) PDK 과발현높은 혈청 PDK3 수준은 CCA 환자의 생존 시간 단축과 관련이 있습니다. PDK1 발현은 해당과정과 CCA 세포 증식을 촉진합니다.(37) HIF1α/PDK1/PDHA1 경로에 의해 매개되는 SIRT3 효과 SIRT3 발현의 감소는 저산소증 유발 인자 α(HIF1α)/PDK1/PDHA1 축을 통해 해당과정 흐름을 유도합니다. CCA 진행을 촉진합니다.(38)PI3K-AKT-mTOR 신호 전달의 규제 완화단백질 과발현 및 PI3K 활성화는 종양 진행, 분화, 결절 침범 및 OS 감소와 관련이 있습니다. 활성화된 형태의 AKT의 상향 조절은 AKT와 비교하여 종양 세포에서 보고되었습니다. 주변 정상 조직. 증가된 mTOR 유전자 카피 수와 증가된 phospho-mTOR 수준은 인접한 정상 또는 이형성 상피와 비교하여 담도 암종 표본에서 설명되었습니다. PTEN 손실은 CCA에서 열악한 종양 분화, 결절 침범 및 더 짧은 생존과 관련이 있습니다.(39, 40, 41, 42) SIRT2 과발현 SIRT2 및 이의 하류 표적 cMYC는 인간 CCA 세포주 및 모든 48개 CCA 샘플에서 인접 세포와 비교하여 과발현되었습니다. 조직. SIRT2/cMYC 경로는 OXPHOS 억제 및 SSP 활성화를 통해 CCA 대사를 재프로그래밍하여 ROS 생성에 대응할 수 있습니다. 산화 스트레스로 인한 세포 사멸로부터 CCA 세포를 보호합니다.(43)UCP2 과발현UCP2의 상향 조절은 CCA 세포에서 EMT 및 세포 침입을 유지합니다.(44)FXR 하향 조절CCA의 시작 및 진행, FXR 발현의 하향 조절 조절은 에너지를 조절하여 암 발달을 촉진할 수 있습니다. CCA 세포의 대사.(45)PPAR-α 상향 조절은 CCA 환자의 종양 발생 및 진행을 촉진할 수 있습니다.(46, 47)IDH1 및 IDH2 돌연변이포도당 섭취 및 포도당 대사가 증가하고 TCA 주기에서 일부 대사산물이 상향 조절됩니다. PFKP의 상향 규제. ( 48 ) 미토콘드리아 대사 PGC1α의 상향 조절 시험관 내 및 생체 내 둘 다에서 CCA 전이를 촉진합니다. ( 49 ) 자극된 Sirt1/FOXO1 CCA 세포에서 자가포식 및 미토콘드리아 기능 장애에 관여. ( 50 ) 지질 대사 FASN의 하향 조절. 인간 및 마우스 iCCA 조직에서 FASN 발현은 비종양 인접 조직에 비해 하향조절되었습니다.(51)CCA 세포주에서 FA 수송체(SLC27A1)SCL27A1의 과발현은 세포 성장을 감소시켰습니다.(52)FA 수송체(FABP5) 과발현예후가 나쁜 상관 관계 eCCA에서.( 53 )COX-2 상향 조절CCA 성장 및 침입을 촉진합니다.( 54 , 55 , 56 , 57 , 58 )단백질 대사글루타민 고갈강한 고갈: 증식 정지 또는 세포사멸 유도(시험관 내 글루타민 중독).점진적 감소: eCCA 세포(EGI-1 및 TFK-1)는 글루타민 중독을 극복하기 위해 장기간의 글루타민 철수 시 증식할 수 있습니다.(59) 주변 종양 세포에서 아르기닌의 ASS 결핍. CCA 세포 증식 감소는 CCA 세포 증식 감소로 이어질 수 있습니다.(60)LAT1 과발현 따라서 mTOR 경로의 활성화는 세포 증식 및 생존력에 영향을 미칩니다.(61,62,63)철 대사TfR1 고발현 CCA 진행 및 불량한 임상 결과에 기여합니다.( 64) CCA 환자에 대한 페리틴 고발현 음성 예후 지표.(65) Fpn 감소된 mRNA 수준 일치된 주변 간과 비교하여 CCA 환자 샘플에서 종양 세포로부터의 철분 방출 감소는 철분 함량의 증가가 음성 예후임을 시사합니다. 이는 이것이 요인임을 시사합니다(65).